抗体職人は、動物免疫を用いず、固定した抗原に対し、in vitro でセレクションを行います。そのため、ペプチドやタンパク質を調製したままの状態や環境で結合反応を行うことができることから、領域を絞り込むなど、細かな抗原の設計が可能となります。
ここでは、特定の Ser がリン酸化されたタンパク質を認識する抗体を取得するために、ペプチド抗原を用いた抗体の作製例をご紹介します。
1.抗原の用意
特定のSerがリン酸化された領域を認識する抗体を作製したいため、抗原は、この配列を中心に設計したペプチドを用います。
1-1.ターゲットとなる領域をしぼる
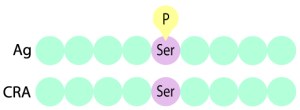
抗原となるペプチドは、リン酸化されたSerが中心付近となり、配列内にCysを含まないような領域を選定します。
![]()
1-2.抗原と陰性対照抗原を設定する
抗原として、リン酸化されたSerをもつペプチドを使用します。さらに、陰性対照抗原として、同じ配列でリン酸化されていないSerを含むペプチドも用意します。このように陰性対照抗原には結合せずに、抗原だけに結合する抗体をスクリーニングしていくことで、リン酸化されたSerのみに結合する抗体がセレクションされていきます。
- 抗原(Ag):リン酸化Serが中心付近あるアミノ酸9個の長さのペプチド
- 陰性対照抗原(CRA):抗原と同じ配列でSerがリン酸化されていないペプチド
1-3.ペプチドを合成する
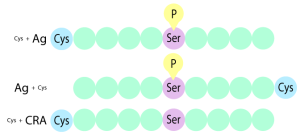
抗体職人は、すべて in vitro でセレクションを行うため、抗原を固定する必要があります。今回は、抗原ペプチドをキャリアタンパク質へ結合させ、キャリアタンパク質を介して、抗原を固定します。そのため、抗原ペプチドは、キャリアタンパク質と結合できるように、N末端/C末端に、システインを付加したものを合成します。
- 抗原ペプチドのN末端にCysを付与(Cys+Ag)
- 抗原ペプチドのC末端にCysを付与(Ag+Cys)
- 陰性対照抗原ペプチドのN末端にCysを付与(Cys+CRA)
2.特異性を上げるセレクション
2-1.末端などに結合する抗体をのぞく
リン酸化の有無を見分ける抗体は、リン酸化されているペプチド抗原に結合し、リン酸化されていないペプチド抗原(陰性対照)には結合しない抗体をセレクションすることで選定できますが、この方法だけでは、ペプチド抗原の末端やキャリアタンパク質に結合する抗体もセレクションされてきてしまいます。
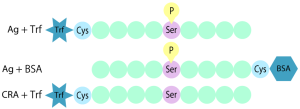
このような抗体を除くために、ペプチド抗原のN末端にキャリアタンパク質Trf(ヒトトラスフェリン)を結合したコンジュゲートと、C末端にキャリアタンパク質BSAを結合したコンジュゲートの両方に結合する抗体を、さらに選定していくことで、両コンジュゲートに共通な部分に結合する抗体以外、すなわち、ペプチド末端やキャリアタンパク質などに結合する抗体は、セレクション中に除かれていくという戦略になります。
- Ag+Trf:抗原ペプチドのN末端システインを用いてTrfにチオールカップリングしたもの
- Ag+BSA:抗原ペプチドのC末端システインを用いてBSAにチオールカップリングしたもの
- CRA+Trf:陰性対照抗原ペプチドのN末端システインを用いてTrfにチオールカップリングしたもの
2-2.複数の抗原で選択圧を高める
2-2-1.ファージを用いたセレクション(パニング)
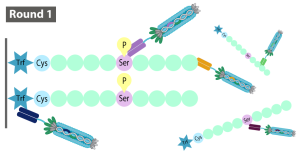
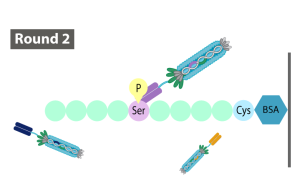
450億パターンの抗体を提示しているファージライブラリから、陰性対照抗原に反応するファージを洗浄して除き、抗原へ反応したファージを回収して増幅するパニングを3ラウンド繰り返します。3ラウンドのパニングで、2種類のコンジュゲートを交互に抗原として用いるため、2種類のコンジュゲートに共通する部分に反応するファージを回収することができます。
- ラウンド:(抗原)抗原ペプチド+Trf
(ブロッカー)陰性対照抗原ペプチド+Trf - ラウンド:(抗原)抗原ペプチド+BSA
(ブロッカー)陰性対照抗原ペプチド+Trf - ラウンド: 第1ラウンドに同じ。
2-2-2.大腸菌で発現させた抗体で選定(ELISA)
パニングで、2種類のコンジュゲートに反応したファージから、抗体の遺伝子部分のみを大腸菌の発現ベクターに組換え、組換えタンパク質として抗体を調製します。組換え体のライセートに含まれる抗体を用いて、抗原と陰性対照抗原に対してELISAを行い、抗原と結合し、陰性対照抗原には結合しない抗体をスクリーニングしていきます。

3.抗体の選定
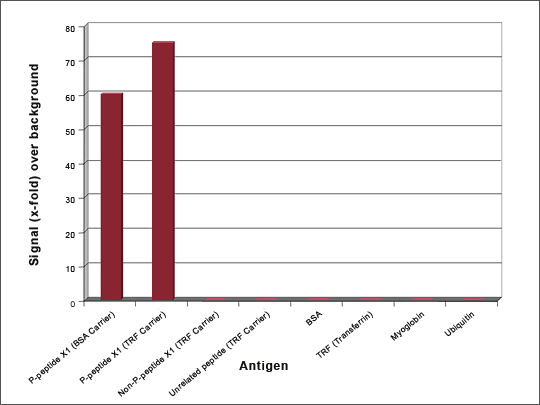
3-1.ELISAでSN比を調べる
ELISAスクリーニングで陽性となったクローンから抗体を精製し、2種類のペプチド抗原のコンジュゲートと、陰性対照抗原のコンジュゲートを、それぞれ固定したプレートを用いてELISAを行います。以下のプレートで、プレート1と2に対するELISAシグナルが、プレート3に対して5倍以上である陽性クローンを選んでいきます。
- プレート1:抗原ペプチド+Trf を固定する(P-peptide X1 (TRF Carrier))
- プレート2:抗原ペプチド+BSA を固定する(P-peptide X1 (BSA Carrier))
- プレート3:陰性対照抗原ペプチド+Trf を固定する(Non-P-peptide (TRF Carrier))
3-2.抗体の塩基配列を確認する
ELISAで陽性となったクローンは、それぞれ大腸菌の発現ベクターに組み込まれているため、その塩基配列を調べることができます。ELISAの結果から、選んだ陽性クローンは同じ塩基配列をもつものも含まれるため、それぞれの塩基配列を確認し、ユニークなクローンを最終的に選んでいきます。
4.まとめ
特定のSerがリン酸化されたものを見分ける抗体を作製する際、タンパク質を抗原とすると、ターゲットとしない領域にも結合する抗体がたくさん取れてきてしまいます。そのため、予めターゲットとなる領域でペプチドを合成し抗原とすることで、より多くの抗体をターゲット領域の周辺から獲得し、陰性対照とのSN比を確認することで、より特異性の高い抗体を得ることができます。柔軟な抗原の設計ができることが、セレクションをすべて in vitro で行う最大のメリットです。

