PCR産物を鋳型DNAとして使用する場合
目的タンパク質をコードする遺伝子部分を増幅し、その後に、目的タンパク質の上流配列部分を含めた断片として増幅する、2段階PCRによる鋳型DNAの調製方法について解説します。
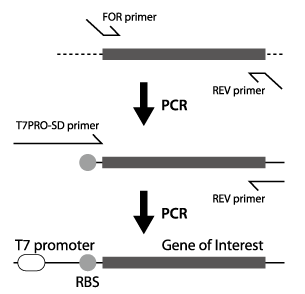
2段階PCRによる鋳型DNAの調製方法
鋳型DNAの調製に用いるPCR酵素は、正確性の高い酵素(KOD(TOYOBO)、PrimeSTAR (TAKARA-BIO)、Pfu(Promega)など)を使用してください。2段階PCRを用いた鋳型DNAの調製の概略を下図に示します。
2段階PCRで用いるプライマーの配列例
1段階目のPCRで使用するFOR primerとREV primerは、お客様の方でご用意頂きます。
各種プライマーの配列
下記サイトのテキスト情報もご利用ください。
https://www.genefrontier.com/solutions/dhfr_dna/
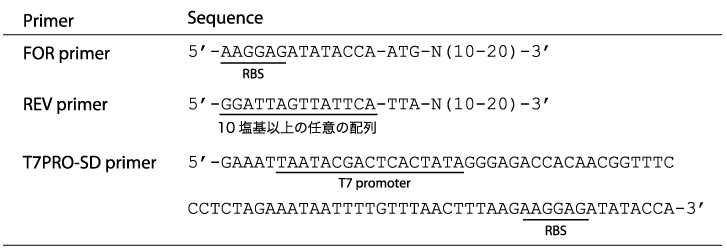
FOR primer
目的タンパク質をコードする遺伝子の開始メチオニンの上流に、T7PRO-SD primerの一部の配列が含まれるように設計します。例えば、リボソーム結合部位(RBS(SD配列))以降を含んだ配列の例を上の表に示しています。
REV primer
目的タンパク質をコードする遺伝子の終止コドンに、10塩基以上の配列が追加されるように設計します。この配列は任意ですが、一例を各種プライマーの配列を上の表に示しています。
1段階目のPCR
お客様の方でご用意頂いたFOR primerとREV primerを用いて、目的タンパク質をコードする遺伝子の上流に位置するリボソーム結合部位(RBS(SD配列))から終止コドン+10塩基以上の配列を含む断片を増幅します。1段階目のPCRでも副産物がほとんど検出されないようにPCR条件を調整します。
2段階目のPCR
1段階目のPCRで得られたPCR産物から、T7PRO-SD primerとREV primerを用いて、目的タンパク質をコードする遺伝子の上流にT7プロモーター配列とRBSを含むPCR断片を増幅します。
PCRで鋳型DNAを作製する際の注意点等
PCR産物の純度について
PCR後の電気泳動で目的産物以外にバンドが見られる場合は、PCR条件を検討して副産物の生成を抑えてください。副産物からもタンパク質が合成されることがあり、PCRで得られるバンドの純度がタンパク質の合成効率に影響します。
PCR条件を変更しても副産物が生じる場合は、目的のバンドをゲルから切り出して精製してください。ゲルから切り出す際には、DNAの損傷(転写反応が阻害されます)を防ぐために紫外線は照射しないでください。ブルーライトは使用可能ですが、できるだけ照射時間を短くしてください。
PCR産物の添加量について
PUREfrex®の反応液に添加する鋳型DNA量は、分子数(モル濃度)が基準となっており、最終濃度が2 nM前後となるように添加してください。1 kbpあたり0.5~3 ng/µL反応液が目安となります。
未精製のPCR反応液をPUREfrex®に添加して反応することも可能ですが、PCR反応液からの塩などの持ち込みを抑えるため、添加量はPUREfrex®の反応液量の1/10 以下にしてください。転写・翻訳反応とも、PCR反応液からの持ち込みによる塩濃度の変化などによって活性が低下します。
PCR産物量が不足している場合は、未精製のPCR反応液の添加量を増やすことは避け、DNA精製キットなどを用いて十分な濃度になるようにDNA溶液を調製してください。
DNAを溶解する際の注意点
TEバッファーに含まれるEDTAは、転写・翻訳反応に必須なマグネシウムイオンをキレートするため、タンパク質合成反応を阻害してタンパク質合成量を下げることがあります。DNAを溶解する際には、EDTAを含まないバッファーやミリQ水などを使用することをおすすめします。また、RNaseが混入すると、合成反応液中の転写産物などのRNAが分解されるため、PUREfrex®を使用する際には、ヌクレアーゼフリーの水、試薬、器具類を使用し、手袋やマスクの着用をおすすめします。