プラスミドを鋳型DNAとして使用する場合
T7 promoter、SD配列、T7 terminatorを含むベクターが使用できます。例えば、pET系(Merck社)、pQE系(Qiagen社) 等があります。
プラスミドの調製方法
プラスミドDNAを調製する際は、精製時に使用したバッファーに添加したRNaseの活性が最終精製物に残っていないことが重要です。
例えば、Qiagen社のQIAprep Spin Miniprep Kitや、Promega社のWizard Plus SV Minipreps DNA Purification Systemのようなメンブレンタイプの精製キットを使用した場合、Lysis bufferに含まれるRNase Aが最終精製DNA溶液にも混入しています。このまま鋳型DNAとしてPUREfrex®の反応液に添加すると、転写産物などのRNAが分解されタンパク質の合成が阻害されます。
このタイプの精製キットで精製したDNA溶液の場合、Phenol/Chloroform処理によりRNaseを失活させた後、エタノール沈殿などにより再度精製することで、RNase活性を含まないDNA溶液を調製できます。あるいは、RNase inhibitorをPUREfrex®の反応液に添加することで、タンパク質を合成できるようになります。
一方、Qiagen社のPlasmid Mini Kitでは、樹脂に結合したDNAを溶出後、溶出液にisopropanolを加えてDNAを沈殿させるため、RNase活性の混入が抑制されます。このキットで精製したプラスミドを、そのまま使用できることを確認しています。
プラスミドの添加量
PUREfrex®の反応液に添加する鋳型DNAは、分子数(モル濃度)が基準となっており、最終濃度が2 nM前後となるように添加してください。1 kbpあたり0.5~3 ng/µL反応液が目安となります。例えば、反応液に添加するプラスミドの長さが6 kbpの場合、実際のORFの長さに関係なく、
(0.5~3)×6=3~18 ng/µLとなります。
タンパク質の合成量に影響を及ぼす特定の配列
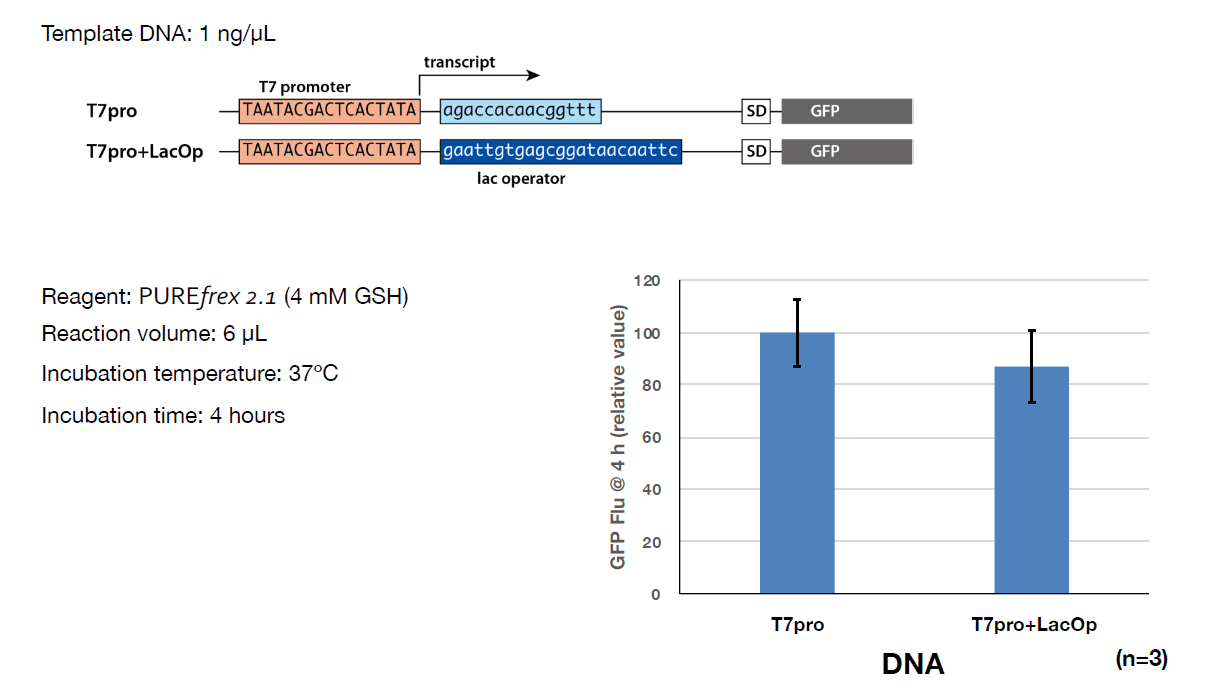
lac operator配列
lac operator配列が存在すると、タンパク質の種類によっては、タンパク質合成量が減少する場合がありますので、lac operator配列を含まないベクター(pET17など)をおすすめします。下図では、lac operator配列の有無で、GFPの合成量を比較した結果を示しています。
N末端側のHisタグと付近の配列
ベクターによっては、目的タンパク質のN末端側に付くHisタグと開始メチオニンの間にGly-Ser-Serの配列があるものがあり、このような場合、タンパク質の種類によっては合成量が低くなることがあります。目的タンパク質の合成量が低い場合は、Gly-Ser-Serの配列を除き、Hisタグの配列を cat cat cat cat cat cat にすると合成量が改善することがあります。
DNAを溶解する際の注意点
TEバッファーに含まれるEDTAは、転写・翻訳反応に必須なマグネシウムイオンをキレートするため、タンパク質合成反応を阻害してタンパク質合成量を下げることがあります。DNAを溶解する際には、EDTAを含まないバッファーやミリQ水などを使用することをおすすめします。また、RNaseが混入すると、合成反応液中の転写産物などのRNAが分解されるため、PUREfrex®を使用する際には、ヌクレアーゼフリーの水、試薬、器具類を使用し、手袋やマスクの着用をおすすめします。