PUREfrex® は、サイトゾル環境を模して還元状態で転写・翻訳の反応をさせるために、還元剤を添加しています。ところが、DTT を還元剤として用い、反応液を長時間インキュベートすると、反応液が酸化状態になっていることが観察されました。
そこで、還元剤の種類を変えて、PUREfrex® の反応液に及ぼす影響や、いくつかのタンパク質を合成し、その活性などに与える影響を確認しましたのでご紹介します。
1.還元剤について
今回の実験で使用した還元剤の種類と構造をまとめました。以下、()内に記載の略称を使用します。
2.PUREfrex® の反応液や構成因子の変化
PUREfrex® の反応液を長時間インキュベートすると、反応液が酸化状態になり、いくつかの因子については、還元剤を添加しないSDS-PAGE で解析すると、バンドの移動度が変化していることが確認されました。
2-1.反応液の変化
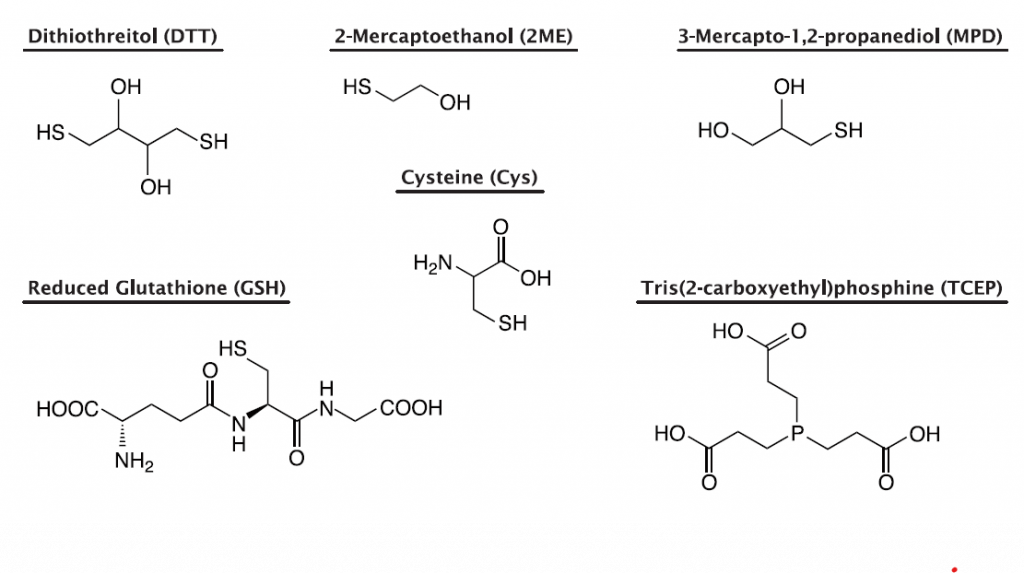
バッファー、アミノ酸、NTP、tRNA、酵素の基質などを含むPUREfrex®のSolution I を還元剤を除いた状態で調製し、異なる還元剤を添加して、24時間インキュベート後、エルマン試薬を用いてSH基を定量しました。
その結果、還元剤の種類によっては、インキュベート後にSH基が検出限界まで減少していることが観察されましたが、Solution I の還元剤として GSH、Cys、2ME を添加してインキュベートした場合は、SH基の減少はほとんどみられず、長時間のインキュベートでも反応液が酸化状態にならないことがわかりました。
2-2.構成因子の変化
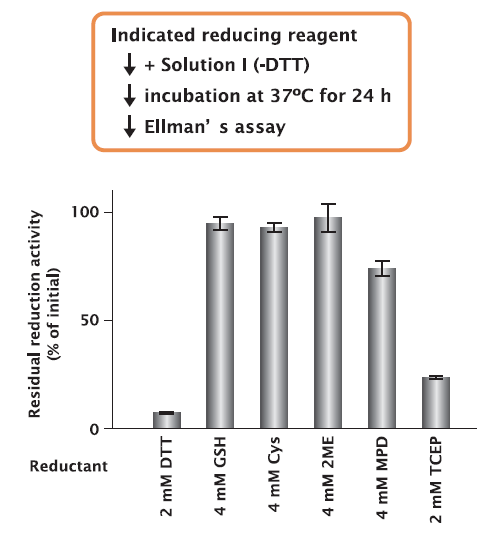
転写や翻訳等に関わるタンパク質性の因子を含む PUREfrex® の Solution II を、異なる還元剤が含まれるよう調製した Solution I とインキュベートした後、還元剤を含まない(Non-Reducing)SDS-PAGE で解析し、バンドの移動度に変化がみられるかどうかを調べました。
その結果、24時間インキュベートした場合、還元剤の種類によっては、いくつかの因子で酸化され、バンドの移動度に変化がみられましたが、GSH、2ME、MPD が含まれている Solution I を使用した場合には、因子のバンドシフトはほとんどみられませんでした。
3.ジスルフィド結合を形成しないタンパク質の合成
異なる還元剤の存在下で、ジスルフィド結合の形成を必要としないタンパク質を合成し、その活性や、合成産物を還元剤を含まない(Non-Reducing)SDS-PAGE で解析し、バンドの移動度に変化がみられるかどうかを確認しました。
3-1.GFP の合成
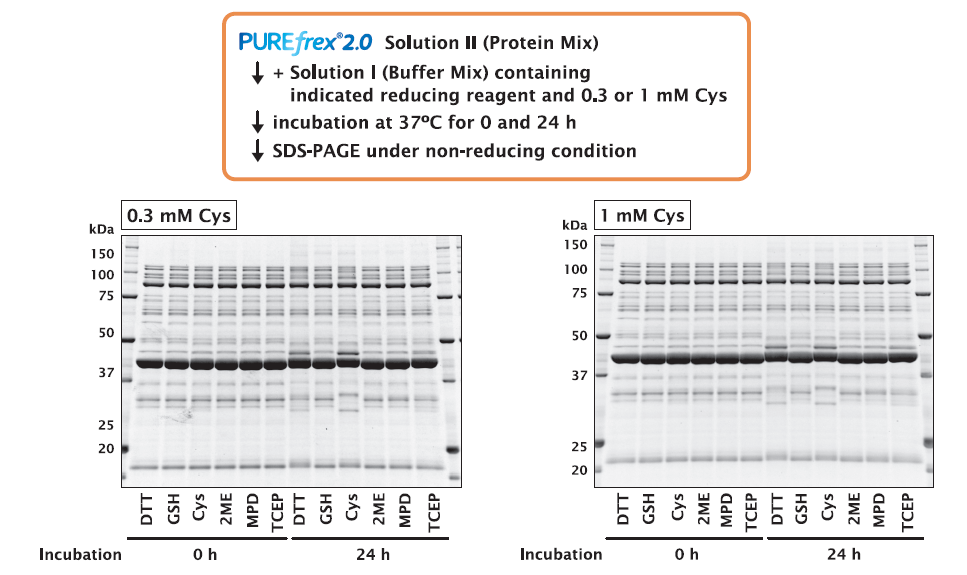
異なる還元剤の存在下で GFP を合成し、4時間と24時間インキュベート後の GFP の活性を蛍光強度で比較しました。
その結果、還元剤の種類により蛍光強度に違いはなく同じような傾向を示しました。このことから、GFP の活性については、還元剤に違いによる影響はほとんどないことがわかりました。
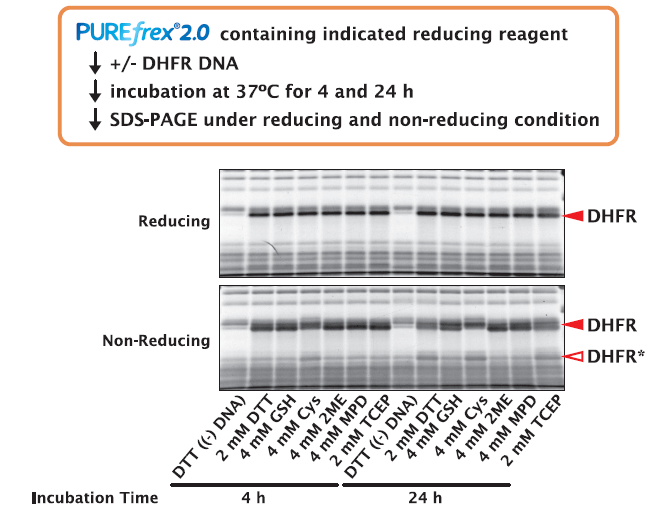
3-2.DHFRの合成
異なる還元剤の存在下で DHFR を合成し、4時間と24時間インキュベート後の DHFR を、還元剤を含んだ(Reducing)SDS-PAGE と還元剤を含まない(Non-Reducing)SDS-PAGE で解析し、バンドの移動度に変化がみられるかどうかを確認しました。
その結果、還元剤の種類により、DHFR の合成量に差は見られませんでした(還元剤を含んだ(Reducing)SDS-PAGE 上の赤色三角)。しかし、還元剤を含まない(Non-Reducing)SDS-PAGE で解析すると、還元剤の種類によっては酸化された DHFR(図中で DHFR*と表記)もみられることがわかりました。Solution I に GSH、2ME、MPD を添加した場合には、酸化された DHFR はほとんど見られませんでした。
4.ジスルフィド結合を形成するタンパク質の合成
異なる還元剤の存在下で、ジスルフィド結合の形成を必要とするタンパク質を合成し、その活性と、合成産物を還元剤を含んだ(Reducing)SDS-PAGE と還元剤を含まない(Non-Reducing)SDS-PAGE で解析し、バンドの移動度に変化がみられるかどうかを確認しました。
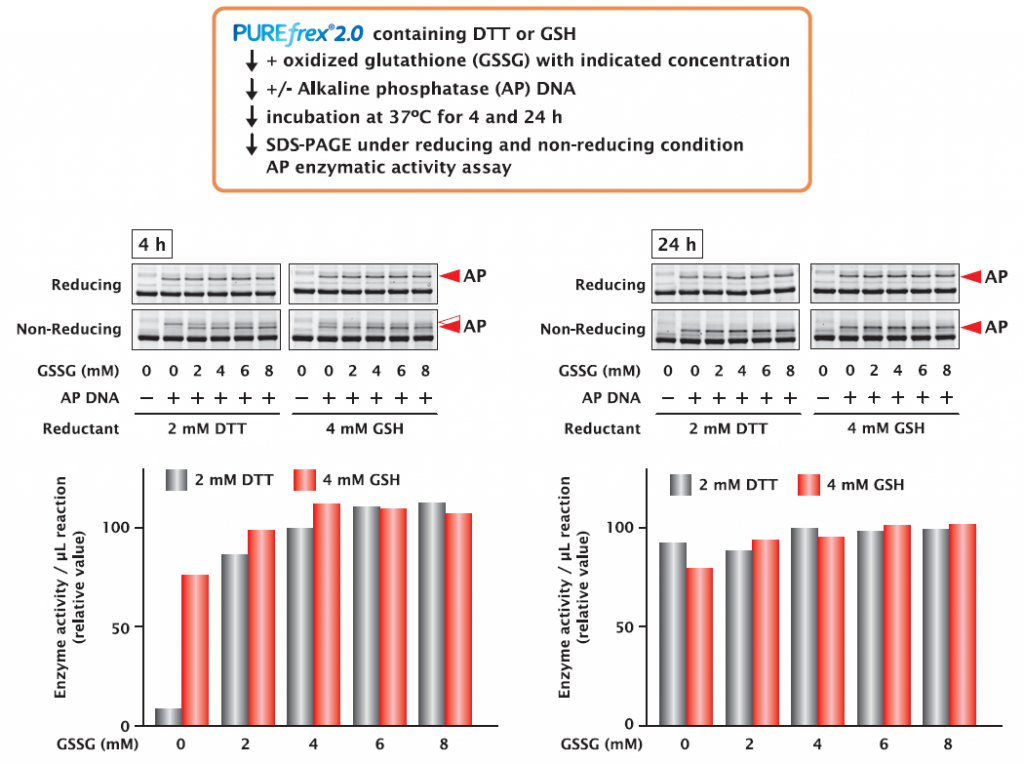
4-1.Alkaline phosphatase(AP)の合成
還元剤として DTT と GSH、酸化剤として GSSG を異なる濃度で組み合わせた条件下で AP を合成し、4時間と24時間インキュベート後に AP の活性を比較し、合成産物については SDS-PAGE で解析してその酸化状態を確認しました。
その結果、4時間インキュベートの場合、還元剤を含まない(Non-Reducing)SDS-PAGE の解析で、還元剤として DTT を用いると、GSSG がない条件下では、ほぼ還元型の AP で存在しており、活性も低い結果になりました。一方、還元剤としてGSHを用いると、GSSG がない条件でも、酸化型の AP が存在しており、活性も示していました。GSSG 存在下の条件では、還元型の AP(白抜きの三角)の存在も確認されましたが、酸化型の AP がメインで存在し、活性も確認できました。
24時間インキュベートの場合、還元剤を含まない(Non-Reducing)SDS-PAGE の解析では、ほぼ酸化型の AP の状態で確認され、GSSG がない条件下でも活性を有しているという結果が得られました。
これらの結果から、AP は、酸化剤(GSSG)を含まない反応液でも、GSH を還元剤として選択するか、長時間のインキュベーションでジスルフィド結合が形成されるタンパク質であることがわかりました。
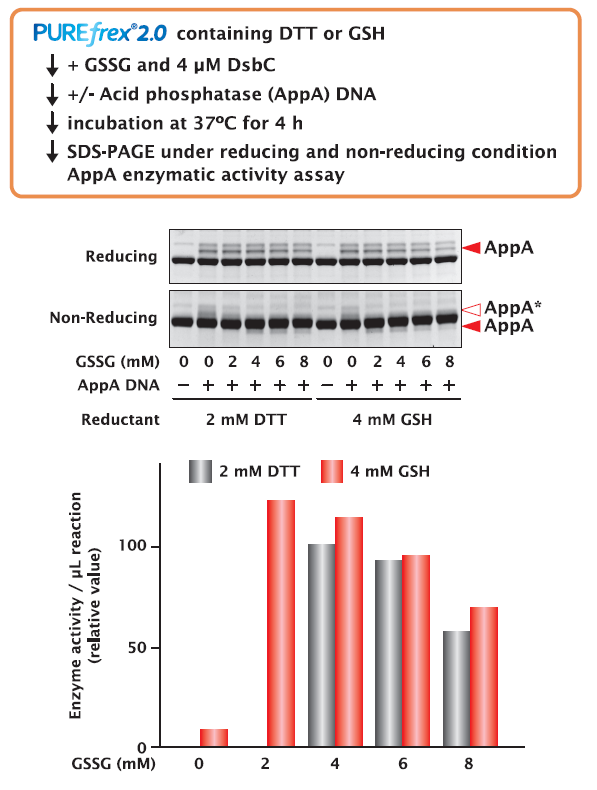
4-2.Acid phosphatase(AppA)の合成
還元剤として DTT と GSH、酸化剤として GSSG を異なる濃度で組み合わせた条件下で AppA を合成し、4時間インキュベート後に活性を比較し、合成産物については SDS-PAGE で解析してその酸化状態を確認しました。
その結果、還元剤を含まない(Non-Reducing)SDS-PAGE の解析で、どの条件下でも、還元型 AppA(図中で AppA*と表記)が存在していましたが、酸化型の AppA(赤色三角)の存在比が高いほど、高い活性を示していました。AppA の場合、DTT よりも、GSH の方がジスルフィド結合が形成されやすい傾向にあることがわかりました。
4-3.IgG(Trastuzumab)の合成
異なる還元剤の存在下で、Trastuzumab の H鎖と L鎖の鋳型DNAを同時に同じ反応液内で合成し、16時間インキュベート後に IgG の構造を形成しているかどうか、還元剤を含まない(Non-Reducing)SDS-PAGE の解析で確認しました。
その結果、H鎖と L鎖のどちらについても、還元剤の種類による合成量の違いは見られませんでした(還元剤を含む(Reducing)SDS-PAGE 解析での比較)が、IgG 形成の効率については、還元剤の種類により違いがあり、DTT と TCEP を用いた場合には、IgG がほとんど形成されませんでした。

5.まとめ
還元剤の種類によっては、PUREfrex® の反応液自体、さらに一部の構成因子が酸化傾向になることが確認されました。
今回調べたタンパク質について、ジスルフィド結合を必要としないタンパク質については、4時間インキュベートでは還元剤の種類による大きな影響は見られませんでしたが、24時間インキュベート後は、還元剤の種類により、酸化型の合成産物がみられるタンパク質もあることがわかりました。
ジスルフィド結合を必要とするタンパク質については、ジスルフィド結合の形成の最適条件はタンパク質により異なることが確認され、合成するタンパク質ごとに、還元剤と酸化剤の混合比をふった条件検討が必要であることがわかりました。
また、IgG のように分子間でジスルフィド結合の形成を必要とする場合は、その形成に長時間のインキュベートを要し、さらに、還元剤の種類によって、IgG の形成効率が異なることがわかりました。
これらの結果から、ジスルフィド結合の形成を必要とするタンパク質の合成は、還元剤と酸化剤の混合条件を最適化し、特に分子間でジスルフィド結合の形成を必要とするタンパク質の場合は、還元剤の種類の検討と長時間インキュベートさせることをおすすめします。

