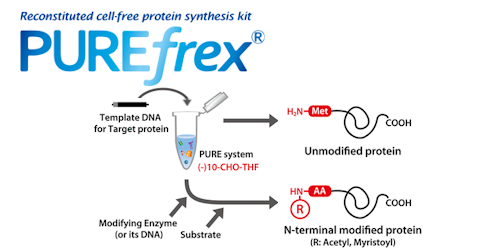
タンパク質の翻訳後修飾の中で、N末端のアセチル化やミリストイル化はもっとも多い修飾の一つであり、タンパク質の相互作用や細胞内局在などに関与しています。これらの翻訳後修飾の重要性を理解するためには、修飾されたタンパク質と未修飾のタンパク質を比較して解析することが重要です。しかし、大腸菌などの生細胞を使用する通常のタンパク質調製の方法では、細胞に内在する修飾酵素のため、未修飾と修飾されたタンパク質を制御して調製することが困難でした。
本研究では、タンパク質合成に関与する因子のみから構成されている「PURE system(製品名:PUREfrex®)」を使用して、N末端修飾された目的タンパク質を調製する方法を検討し、アセチル化もしくはミリストイル化されたタンパク質を、完全に制御した状態で合成することに成功しました。
1) ホルミル化されていない開始メチオニンからのタンパク質合成
通常のPURE systemを用いたタンパク質合成では、大腸菌内の翻訳反応と同様にホルミル化されたメチオニンから翻訳されています。しかし、開始メチオニンのアミノ基がホルミル化されているとN末端修飾が行われません。そこで、ホルミル基の供与体(10-Formyl-tetrahydrofolate; 10-CHO-THF)を除いたPURE systemを用いたタンパク質合成を行いました。その結果、10-CHO-THFを除いても、合成効率の低下が確認されましたが、目的タンパク質が合成されることを確認しました。
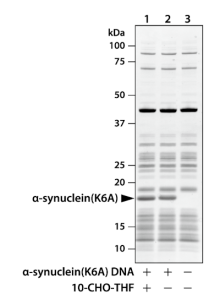
2) NatBによるN末端のアセチル化
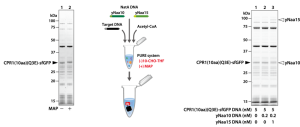
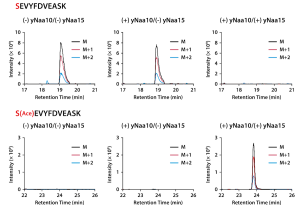
酵母のNatBは、yNaa20とyNaa25からなるヘテロダイマーの酵素であり、ホルミル化されていない開始メチオニンのアミノ基に、アセチルCoAのアセチル基を転移します。10-CHO-THFを含まないPURE systemに、目的タンパク質、yNaa20及びyNaa25の鋳型DNAとアセチルCoAを加えて反応させました。合成された目的タンパク質のN末端ペプチドを質量分析で解析し、NatBのDNAを加えた場合にアセチル化されることを確認しました。
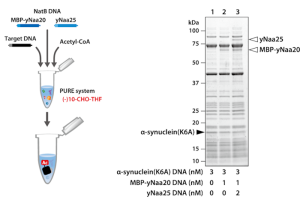
3) NatAによるN末端のアセチル化
酵母のNatAは、yNaa10とyNaa15からなるヘテロダイマーの酵素であり、開始メチオニンがmethionine aminopeptidase (MAP) で切断されて露出する2番目のアミノ酸のアミノ基に、アセチルCoAのアセチル基を転移します。そのため、NatAによるアセチル化を行う場合は、MAPによるN末端の開始メチオニンの除去も必須になります。MAPはホルミル化されていない開始メチオニンを切断するため、10-CHO-THFを含まないPURE systemに、目的タンパク質、yNaa10及びyNaa15の鋳型DNAと精製MAP、アセチルCoAを加えて反応させました。合成された目的タンパク質のN末端ペプチドを質量分析で解析し、NatAのDNAを加えた場合にアセチル化されることを確認しました。
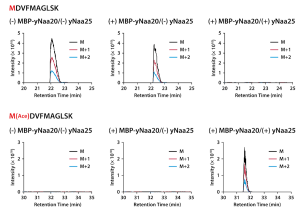
4) NMTによるN末端のミリストイル化
NMTは、MAPで開始メチオニンが切断されることで露出する2番目のグリシンのアミノ基をミリストイル化する酵素です。基質であるミリストイルCoAがタンパク質合成反応を阻害したため、はじめに10-CHO-THFを含まないPURE systemで目的タンパク質及びNMTをそれぞれ合成しました。その後、それぞれ合成した目的タンパク質、NMT及びミリストイルCoAを混合してミリストイル化反応を行いました。合成された目的タンパク質のN末端ペプチドを質量分析で解析し、NMTを加えた場合にミリストイル化されることを確認しました。


また、上記のミリストイル化反応をリポソーム内で行うと、ミリストイル化タンパク質が膜に局在する様子が観察されました。
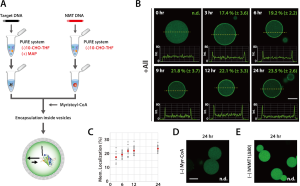
- 実験手順の概略 (A)
- 開始メチオニンが除かれたGFPはhNMT1(Δ80) によってリポソーム内でミリストイル化され、リポソーム膜への移行が観察されました (B)
- GFP の膜局在化の比率を、3、6、9、12、および 24 時間の反応時間に対してプロットしました (C)
- ミリストイル-CoA (D) または、hNMT1(Δ80) 遺伝子 (E) を添加しなかった場合、GFP の膜局在化は観察されませんでした
<まとめ>
本研究の結果は、PURE systemを用いることにより、N末端修飾タンパク質を完全な制御下で調製することが可能であることを示しており、翻訳後修飾された合成タンパク質が、リポソームの膜に局在できることも確認できました。また、修飾酵素もPURE systemで合成し、精製することなく修飾反応に用いています。この手法は他の修飾酵素にも適用でき、さまざまな翻訳後修飾反応の解析や利用を簡便に行うことができると考えています。
本研究は、ジーンフロンティア社と東京工業大学および海洋研究開発機構(JAMSTEC)の共同研究です。論文はACS Synthetic Biology誌に掲載されており、以下のリンクから無料でダウンロードが可能です。
“Regulated N-Terminal Modification of Proteins Synthesized Using a Reconstituted Cell-Free Protein Synthesis System”
ACS Synthetic Biology (2023) 12, 1935-1942
関連する製品・サービス