PUREfrex® は、大腸菌でタンパク質合成に関与する因子を再構成した無細胞タンパク質合成系(PURE system)ですが、反応液の改良などにより、合成量は最大で 1 mg/mL 程度まで増大しており、反応液の酸化還元状態の調整やジスルフィドイソメラーゼの添加により、様々なジスルフィド結合含有タンパク質を、活性型で合成することも可能となっています。
一方で、合成が難しいタンパク質も存在しています。例えば、連続したプロリン残基(Pro-Pro-ProやPro-Pro-Gly)を含む一部のタンパク質は、合成が難しいことが多く、大腸菌の中では、EF-P(elongation factor P;翻訳伸長因子 P)と呼ばれる翻訳因子が関与することが知られています。今回は、プロリンが連続した配列をもつタンパク質について、PUREfrex® に EF-P を添加して合成を行い、それぞれの合成量を比較しました。
1)EF-Pについて
EF-P の翻訳後修飾の有無により、PUREfrex® における翻訳への促進効果に違いがあるかどうかを調べるため、EF-P は、EpmA(Elongation factor P–(R)-beta-lysine ligase) と EpmB(L-lysine 2,3-aminomutase) により34位リジン側鎖にβリシル化という翻訳後修飾を受けたもの(図中 modified EF-P)と、修飾を受けていないもの(図中 unmodified EF-P)を使用しました。翻訳後修飾を受けた EF-P (#PFS052-0.5)キットについては、こちらもご覧ください。
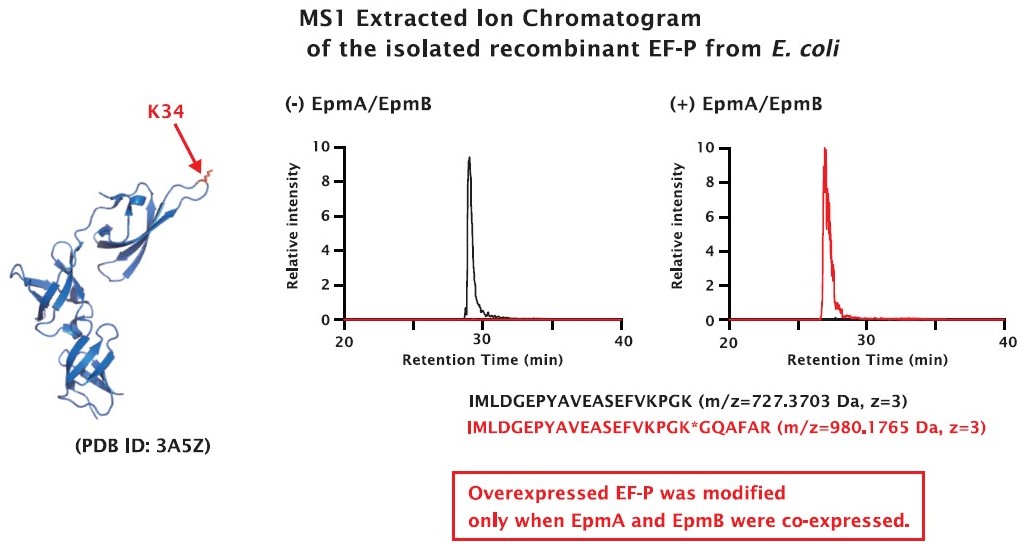
Lysine at 34th is post-translationally modified to β-lysllysine by EpmA (YjeA/GenX) and EpmB (YjeK) and the modification is important for its activity.
2)方法
使用したキット:PUREfrex® 2.0 (#PF201-0.25)
- 翻訳後修飾された EF-P(modified)あるいは 翻訳後修飾されていない EF-P(unmodified)を、PUREfrex 2.0に添加した。
- 最終濃度が2 nM 前後となるように、それぞれの鋳型DNAを1の反応液に添加した。
- 37 ℃ で 4 時間インキュベートした。
3)連続したプロリンを含むタンパク質の合成
3‐1.Interleukin-6
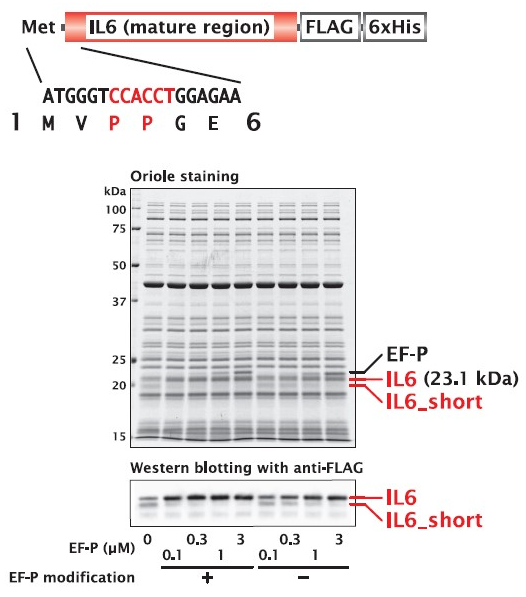
N末端近傍にプロリン連続配列が存在する IL-6 の場合、EF-P を添加せずに合成すると、プロリン残基下流の Gly/Glu/Asp から翻訳された産物(IL-6_Short)が検出されました。EF-P を添加して合成することで、この副産物は消失し、開始 Met からの翻訳産物量が増加しました。
| Organism | Homo sapiens (Human) |
| Gene | IL6 |
| Synthesized region | 31 ‐ 212 (シグナル配列を除く) |
| UniProt ID | P05231 |
| Length | 183 |
| Molecular weight | 23.1 kDa |
| No. of disulfide bonds | 2 |
3‐2.ATP-dependent 6-phosphofructokinase isozyme 2
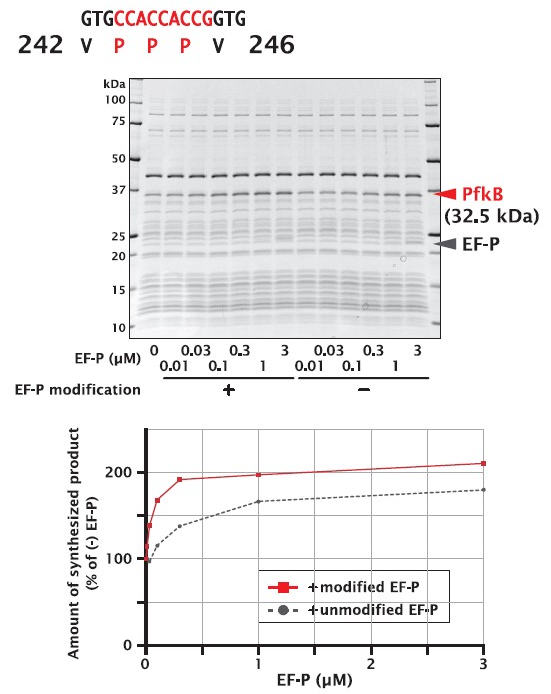
未修飾のEF-P を添加した場合でも、濃度依存的に合成量が増大しましたが、修飾されたEF-Pの方が添加効果が高いという結果が得られました。1 μM の添加量で比較すると、EF-P 未添加で合成したタンパク質量に対し、未修飾 EF-P 添加で約1.7倍、修飾 EF-P で約2.1倍( 0.7 mg/mL)まで、合成量が増大しました。
| Organism | Escherichia coli (strain K12) |
| Gene | pfkB |
| Synthesized region | 18Lys – 185Asp (+FLAG-His6) |
| UniProt ID | P06999 |
| Length | 309 a.a. |
| Molecular weight | 32.5 kDa |
| No. of disulfide bonds | 0 |
3‐3.N-acetylmuramoyl-L-alanine amidase AmiB
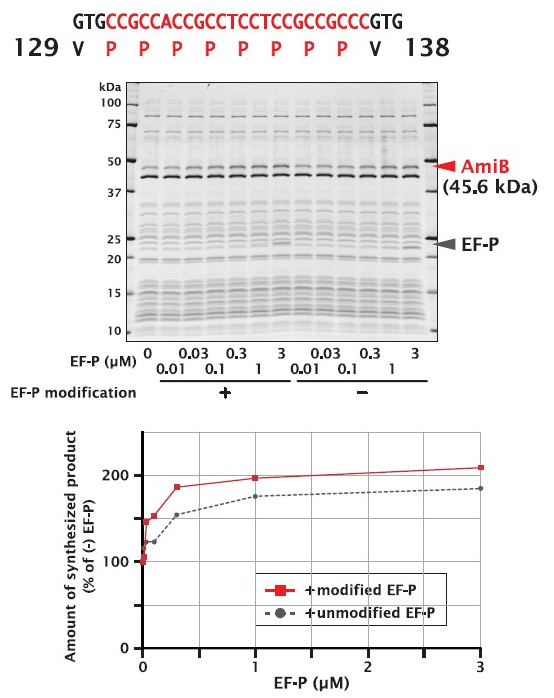
プロリンが8残基も連続する配列を持っているタンパク質です。EF-P 未添加で合成したタンパク質量に対し、EF-P を添加して合成した方がタンパク質量は増大しました。また、未修飾 EF-P よりも、修飾 EF-P の方が、より高い添加効果を示しました。
| Organism | Escherichia coli (strain K12) |
| Gene | amiB |
| Synthesized region | 23 ‐ 445 (シグナル配列を除く) |
| UniProt ID | P26365 |
| Length | 423 a.a. |
| Molecular weight | 45.6 kDa |
| No. of disulfide bonds | 0 |
3‐4.Glutathione hydrolase proenzyme
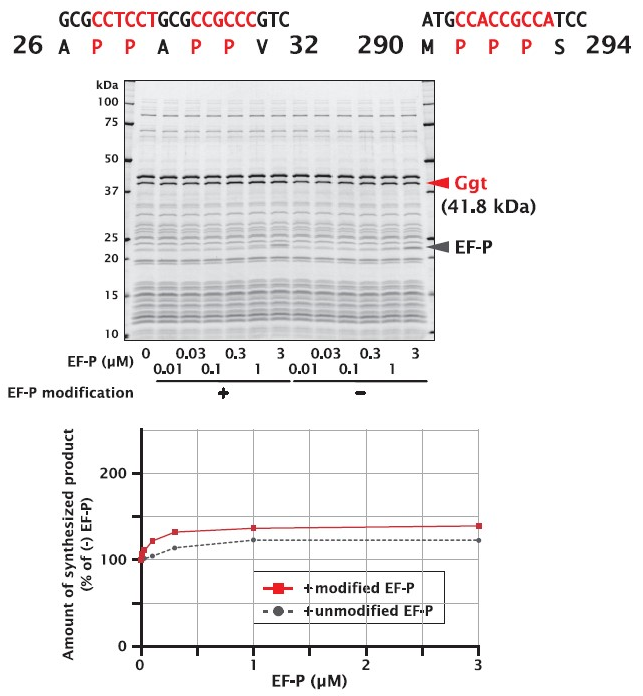
異なる位置で、連続したプロリンを含む配列があるタンパク質です。EF-P 未添加で合成したタンパク質量に対し、EF-P を添加して合成した方がタンパク質量は増大しました。また、未修飾 EF-P よりも、修飾 EF-P の方が、より高い添加効果を示しました。
| Organism | Escherichia coli (strain K12) |
| Gene | ggt |
| Synthesized region | 26 ‐ 390 (シグナル配列を除くlarge subunitのみ) |
| UniProt ID | P18956 |
| Length | 365 a.a. |
| Molecular weight | 41.8 kDa |
| No. of disulfide bonds | 0 |
4)連続したプロリンを含まないタンパク質の合成
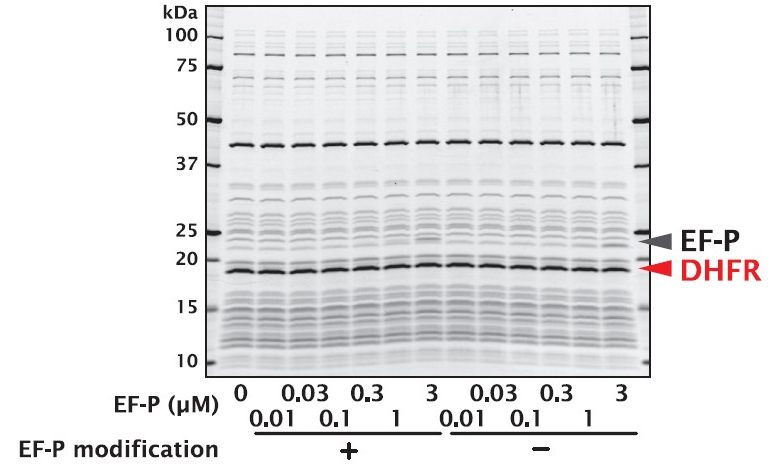
4-1.Dihydrofolate reductase
連続したプロリンを含まない タンパク質です。EF-P の有無に関わらず、タンパク質の合成量に差はありませんでした。
こちらは、PUREfrex® にも、ポジティブコントロールの鋳型DNAとして含まれております。
https://www.genefrontier.com/solutions/dhfr_dna/
| Organism | Escherichia coli (strain K12) |
| Gene | folA |
| Synthesized region | 1 ‐ 159 |
| UniProt ID | P0ABQ4 |
| Length | 159 a.a. |
| Molecular weight | 18 kDa |
| No. of disulfide bonds | 0 |
5)まとめ
PUREfrex® では、連続したプロリン残基を含むタンパク質の合成が難しいことがありますが、EF-P を反応液に添加することで、合成量を改善することができます。連続したプロリンの存在が合成量に影響を及ぼすタンパク質の特徴は、連続するプロリンの数だけに依存するわけではなく、配列中のどこに存在するのか、また、周辺のアミノ酸の種類によっても影響を受けます。EF-P の添加が合成を阻害することは見られなかったことから、連続したプロリンの配列をもつタンパク質の合成時には、EF-P を添加して合成することをおすすめします。

