PUREfrex® は、反応液に添加された鋳型DNAからmRNAに転写され、その転写産物の翻訳が進み、mRANの終止コドンを終結因子が認識して合成されたポリペプチド鎖が遊離されます。
mRNA上の終止コドンは、UAA(オーカー)・UAG(アンバー)・UGA(オパール)の3種があり、原核生物では、RF1とRF2という2つの終結因子がこれらの終止コドンを認識しています。RF1はUAGとUAA、RF2はUGAとUAAをそれぞれ識別します。PUREfrex® には、RF1とRF2の終結因子が含まれいるため、いずれの終止コドンも使用することが可能です。
今回は、RF1とRF2をメチル化することによる活性の違いについて、その効果を調べました。
1.<概要> RF1とRF2のメチル化と活性について
リボソームは大小2つのサブユニットから構成されており、ぺプチド結合の生成はリボソームの大サブユニットで行われています。この大サブユニット中のPeptidyl Transferase Center(ペプチジル転移酵素中心, PTC)という場所で,ぺプチド結合は生成されます。
終結因子には、GGQモチーフとよばれる配列が広く保存されており、このGGQモチーフが、リボソームのPeptidyl Transferase Centerと相互作用し、新しく合成されたポリペプチドがリボソームから遊離していきます。
GGQモチーフのGlnは、原核生物でも真核生物でも特異的にメチル化されていて、大腸菌の終結因子(RF1とRF2)に含まれるGGQモチーフのメチル化は、ペプチドの遊離を活性化することが報告されています。
また、RF2については、246番目のアミノ酸の種類によって、活性に違いがあり、ThrよりもAlaの方が活性が高いと報告されています。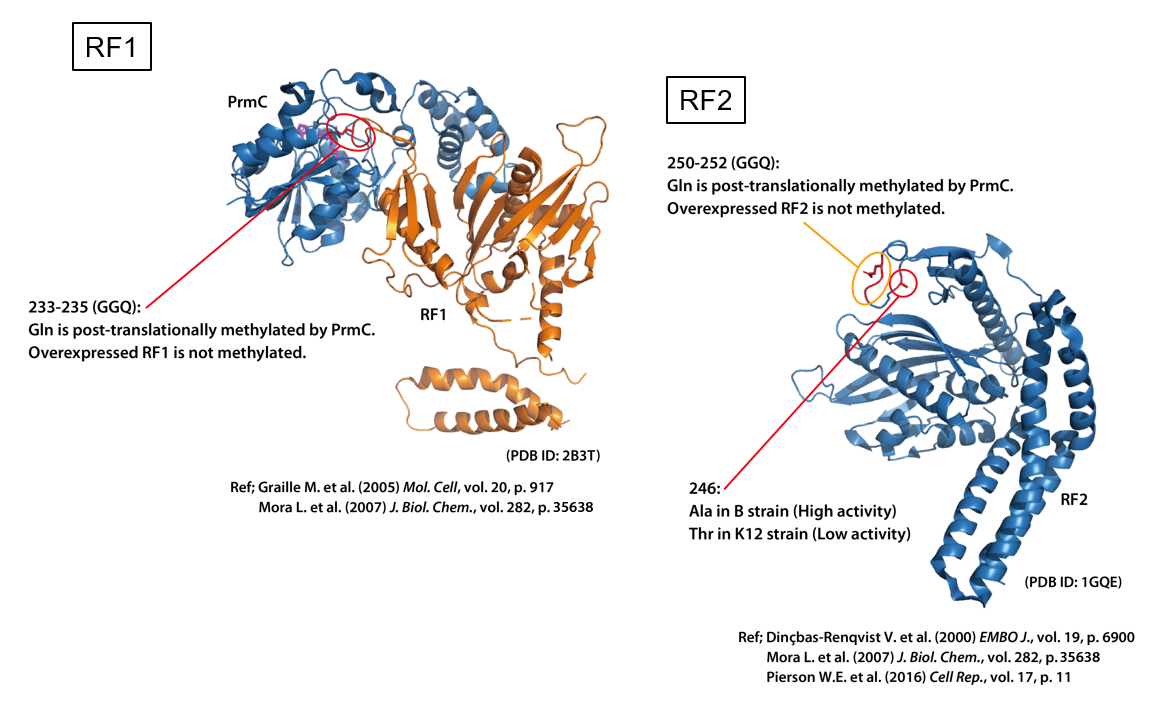
2.リードスルーが起きる鋳型の作製
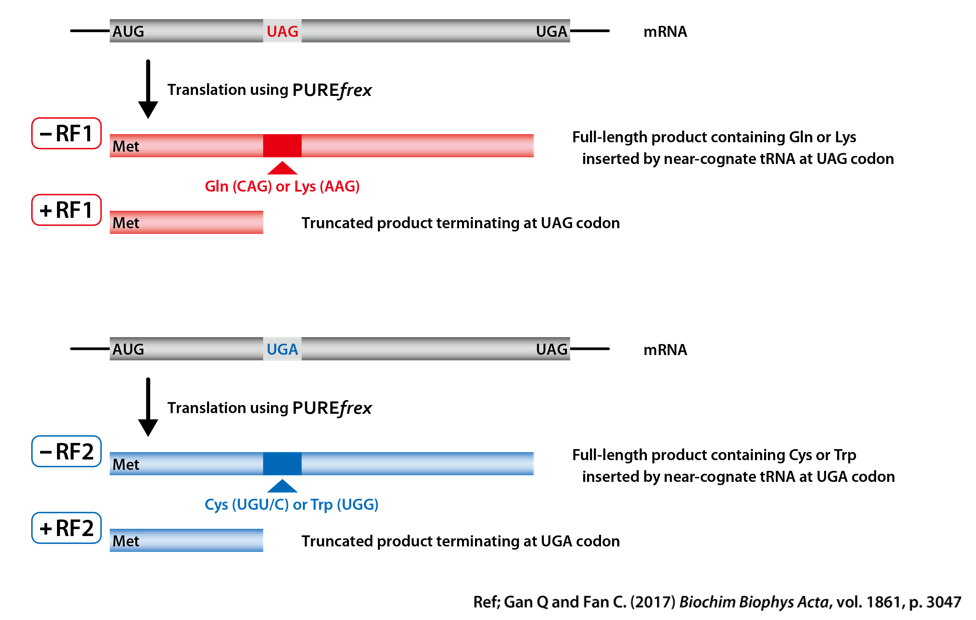
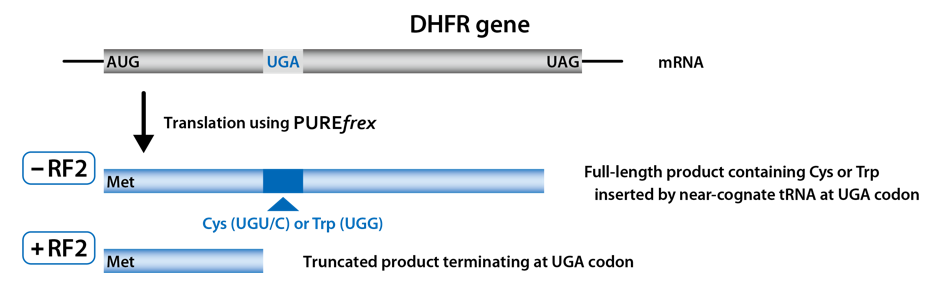
DHFR(ジヒドロ葉酸レダクターゼ;dihydrofolate reductase)の遺伝子の途中に、終止コドンを挿入し、配列の最後には、途中に挿入された終止コドンとは異なる終止コドンを挿入した鋳型DNAを作製しました。RF1あるいはRF2が反応液に含まれない場合には、リードスルー(near-cognate tRNAがRF1あるいはRF2の代わりに挿入)が起こり、全長のタンパク質が合成されるように設計しました。
2-1.鋳型の設計
終止コドン UAG:RF1のみが認識できる
終止コドン UGA:RF2のみが認識できる
2-2.合成の結果
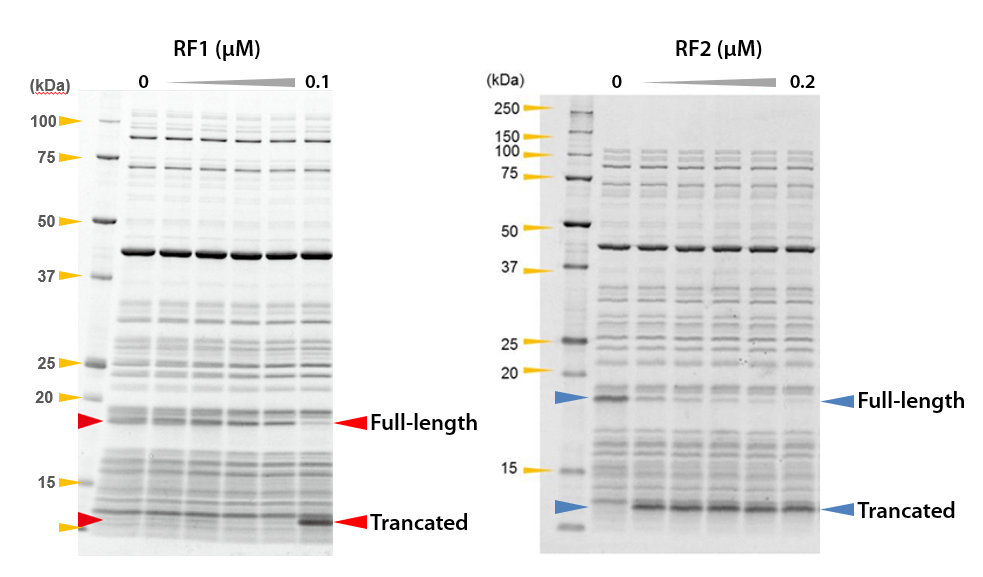
RF1あるいはRF2を反応液に入れない場合(0 µM)には、終止コドンの代わりに類似したコドンの挿入され、DHFRの全長(Full-length)が合成されました。
また、RF1あるいはRF2の添加量を増やしていくと、配列の途中に挿入された終止コドンの場所で合成が終了し、TrancatedなDHFRが検出され、鋳型DNAの設計通りにDHFRが合成されたことが確認されました。
3.RF1の活性比較
DHFR(ジヒドロ葉酸レダクターゼ;dihydrofolate reductase)の遺伝子の途中に、RF1しか認識できない終止コドンUAGを挿入し、配列の最後には、RF2しか認識できない終止コドンUGAを挿入した鋳型DNAを作製しました。RF1が反応液に含まれない場合には、リードスルー(UAGに類似した (near-cognate) tRNAがRF1の代わりに挿入)が起こり、全長のタンパク質が合成されるように設計しました。
3-1.配列の途中に終止コドンUAGを含むDHFRのリードスルー
3-1-1.用意したもの
< 鋳型DNA >
・DHFRの70番目にUAGを挿入し、配列の最後がUGAの配列
・DHFRの87番目にUAGを挿入し、配列の最後がUGAの配列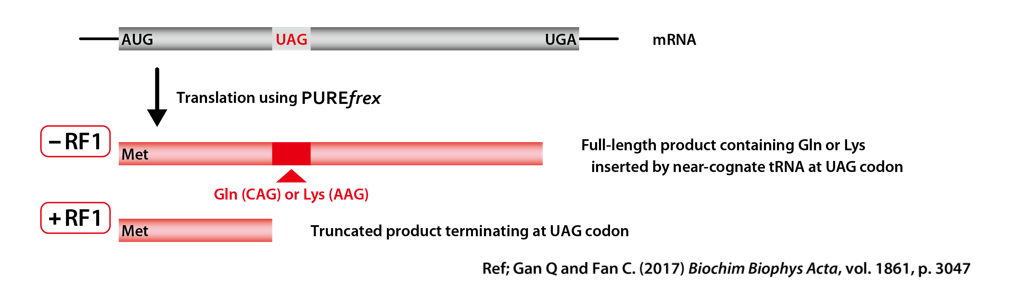
< RF1の種類 >
・メチル化RF1
・メチル化なしRF1
< 反応液 >
・RF1を含まないPUREfrex® 2.0 の反応液
3-1-2.方法
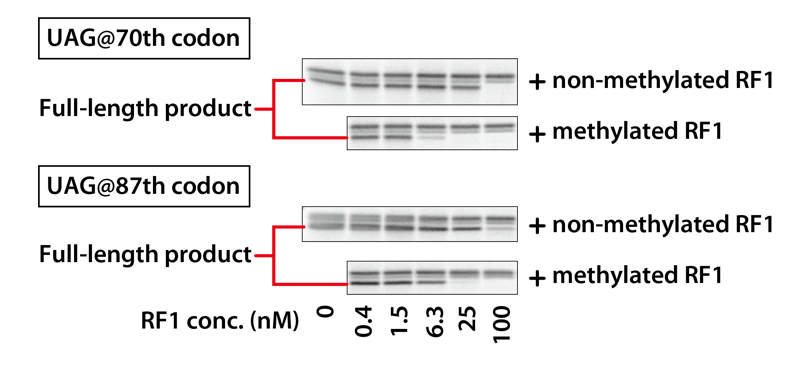
UAGの挿入場所が異なる2種類の鋳型DNAについて、メチル化RF1とメチル化なしRF1の添加量を変えて、それぞれ、PUREfrex® の反応液でDHFRを合成しました。合成されたDHFRをSDS-PAGEに供し、メチル化の有無とRF1の添加量により、長さの異なる合成産物の合成量を比較しました。結果では、Full-lengthの部分のみ表示しています。
3-1-3.結果
メチル化RF1とメチル化なしRF1の比較では、メチル化RF1の方が、より低濃度でFull-lengthのDHFRがほとんど検出されなくなっており、リードスルーが抑えられていることがわかりました。
また、リードスルーの起こりやすさはUAGの挿入場所によっても異なっており、この場合でも、メチル化RF1の方がより低い濃度で効いていることが確認できます。
4.RF2の活性比較
はじめに、246番目のアミノ酸がAlaとThrの場合の2種類のRF2を用意し、それぞれメチル化の処理をしたものとしないものを調製して、計4種類のRF2を用い、DHFRの合成量を比較しました。用いたDHFRの鋳型DNAは、終止コドンとしてRF2のみが認識するUGAを使用し、終止コドンの直前にPro、あるいはAlaを挿入したものを作製しました。
終始コドンの直前にProがある場合、メチル化なしRF2を用いると合成量が低下することを確認しているため、メチル化RF2の効果を比較するためにこのような鋳型DNAを設計しました。
次に、DHFRの遺伝子の途中に終止コドンを挿入した鋳型DNAを用いて、DHFRを合成し、長さの異なる合成産物の量を比較することで、メチル化の有無と246番目のアミノ酸の違いによる活性への影響を確認しました。
4-1.終止コドン直前にProが存在するDHFRの合成量比較
4-1-1.用意したもの
< 鋳型DNA >
・DHFRの終止コドン(UGA)の直前にProを挿入した配列
・DHFRの終止コドン(UGA)の直前にAlaを挿入した配列
< RF2の種類 >
・246番目がAlaのメチル化RF2
・246番目がAlaのメチル化なしRF2
・246番目がThrのメチル化RF2
・246番目がThrのメチル化なしRF2
< 反応液 >
・RF2を含まないPUREfrex® 2.0 の反応液
4-1-2.活性の比較
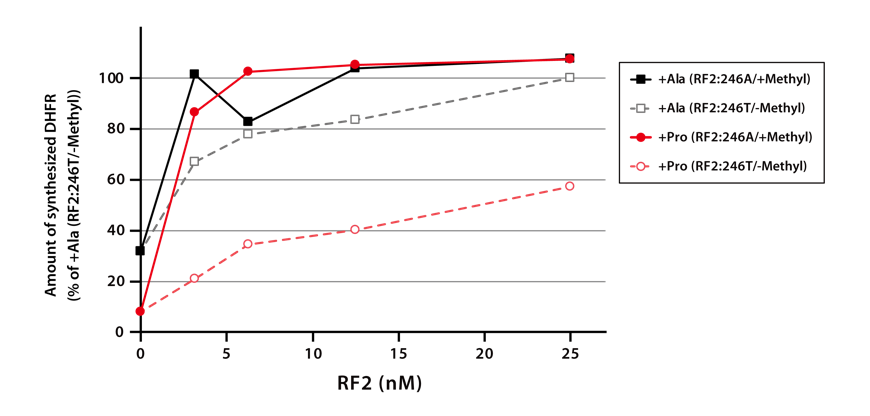
DHFRの配列の最後にRF2しか認識できない終止コドンUGAを挿入し、終始コドンの直前にProが挿入された鋳型と、Alaが挿入された鋳型を作製しました。4種類のRF2について、それぞれ2種類の鋳型DNAからDHFRを合成後、SDS-PAGEに供し、その合成量をRF2の濃度別に比較しました。
4-1-3.結果
メチル化なしのRF2を用いてDHFRを合成した場合、DHFRの合成量は低い傾向にあり、終止コドンの直前がProの場合(下図の赤◯)は、特に合成量が低いという結果が得られました。しかしながら、メチル化RF2を用いてDHFRを合成した場合、DHFRの合成量は改善され、終止コドン直前のアミノ酸の種類にも影響を受けませんでした。
4-2.配列の途中に終止コドンUGAを含むDHFRのリードスルー
4-2-1.用意したもの
< 鋳型DNA >
・DHFRの87番目にUGAを挿入し、配列の最後がUAGの配列
< RF2の種類 >
・246番目がAlaでメチル化RF2
・246番目がThrでメチル化なしRF2
< 反応液 >
・RF2を含まないPUREfrex® 2.0 の反応液
4-2-2.方法
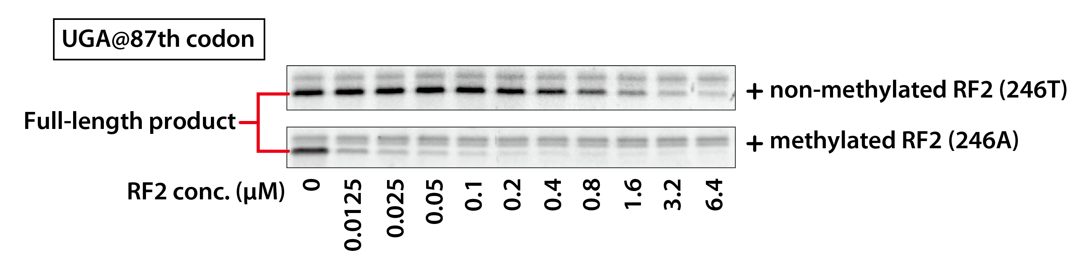
配列の途中にUGAが挿入されたDHFRの鋳型DNAを、メチル化RF2とメチル化なしRF2の添加量を変えて、それぞれ、PUREfrex® の反応液で合成しました。合成されたDHFRをSDS-PAGEに供し、メチル化の有無とRF2の添加量により、長さの異なる合成産物の合成量を比較しました。結果では、Full-lengthの部分のみ表示しています。
4-2-3.結果
メチル化されたRF2とメチル化されていないRF2の比較では、メチル化されたRF2の方が、より低濃度でFull-lengthのDHFRが検出されなくなっており、リードスルーが抑えられていることがわかりました。
5.まとめ
以上の結果から、メチル化されたRF1とRF2は、メチル化されていない場合と比較して、リードスルーが抑えられることが確認できました。
リードスルーによりタンパク質の合成がきちんと終了しておらず、タンパク質の合成量が低かったものについては、活性の高いRF1とRF2を用いることで、ポリペプチドの放出の改善が見込まれ、結果として、タンパク質の合成量が上がることが期待できます。

